Come vengono costruite le strutture proteiche |
|
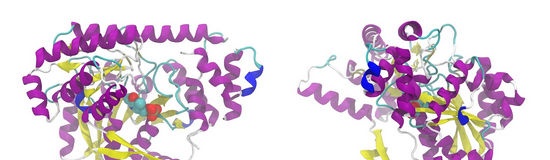
Lo studio delle strutture biologiche, della loro composizione e organizzazione molecolare, della loro specifica attività è diventato oggetto di biologia molecolare. Il successo di quest'ultimo è associato principalmente alla decodifica della struttura degli acidi nucleici e alla natura delle informazioni ereditarie. Una molecola di acido nucleico è una sequenza lineare di quattro tipi di nucleotidi disposti in un ordine complesso ma rigorosamente definito, che può essere confrontato con la disposizione regolare delle lettere in un testo significativo. Proprio come un testo trasporta un messaggio, alcune informazioni, l'ordine dei nucleotidi in una molecola di acido nucleico contiene informazioni sulle singole strutture di proteine che devono essere create nel processo di costruzione di un organismo. Una molecola proteica è anche una sequenza lineare di elementi strutturali, ma non nucleotidi, ma venti tipi di amminoacidi. Ogni combinazione di tre nucleotidi in una molecola di acido nucleico (codice genetico) determina l'inclusione di uno o dell'altro dei venti amminoacidi. La sequenza delle triplette nucleotidiche determina la sequenza esatta degli amminoacidi nella molecola proteica sintetizzata. Continuando il paragone già generalmente accettato dell'informazione genetica con il testo scritto, possiamo affermare che durante la sintesi proteica, il testo scritto nel linguaggio dei nucleotidi viene tradotto nel linguaggio degli amminoacidi. L'informazione contenuta nel testo amminoacidico di un particolare tipo di proteina - cioè la composizione e la sequenza di amminoacidi ad essa inerenti da sola - determina la sua forma e la sottile organizzazione interna - l'ordine spaziale degli elementi strutturali, su cui alcuni dei suoi le funzioni biologiche dipendono. Se questo ordine è disturbato, le proteine enzimatiche, ad esempio, perdono la capacità di catalizzare le reazioni nel corpo. Studi hanno dimostrato che alcune funzioni di una proteina sono svolte direttamente da associazioni di gruppi chimici situati in certe parti di una molecola proteica ordinata - centri funzionali specifici. Quando l'ordine viene interrotto, ad esempio una molecola proteica si scioglie, le combinazioni di gruppi chimici hanno l'opportunità di cambiare la loro disposizione reciproca, la dispersione ei centri funzionali cessano di esistere. Pertanto, la traduzione del linguaggio dei nucleotidi nel linguaggio degli amminoacidi non è solo traduzione. Le lettere di amminoacidi sono molto più ricche di contenuto fisico e chimico rispetto a quelle nucleotidiche. E in generale, le informazioni trasportate da una molecola proteica sono fondamentalmente diverse dalle informazioni sui nucleotidi, poiché determinano la specificità della struttura delle molecole proteiche e le loro più sottili funzioni biologiche. Un ulteriore confronto può essere effettuato dal campo tecnico. Le informazioni contenute negli acidi nucleici sono come schemi da cui le parti vengono prodotte e assemblate in un ordine specifico. Una molecola proteica è un meccanismo assemblato e le informazioni contenute nella sequenza dei suoi amminoacidi sono il programma del meccanismo stesso. In una cellula vivente, la maggior parte delle proteine non funziona in uno stato libero, ma come componenti di strutture complesse - sistemi ben bilanciati e controllabili, in cui ogni proteina ha un certo posto e una certa quota nella funzione fisiologica complessiva. La costruzione di strutture complesse della cellula è una transizione dialettica dal campo della chimica (che dovrebbe includere il funzionamento delle singole molecole proteiche) al campo della biologia. Strutture biologiche complesse, oltre alle proteine, contengono anche lipidi, carboidrati e altre sostanze.Tuttavia, nella costruzione di strutture intracellulari complesse, il ruolo di queste sostanze non è quello principale. Per la natura stessa della loro struttura chimica, carboidrati e lipidi semplicemente non possono contenere quella quantità molto grande di informazioni necessaria per una tale costruzione. Il ruolo più importante in esso appartiene a proteine specifiche. Pertanto, la biologia molecolare odierna conferma e dettaglia la ben nota posizione di F. Engels sulle proteine come base della vita. Nelle proteine, dove molecole infinitamente diverse sono costruite da elementi strutturali con proprietà molto diverse, dove la precisione di un'organizzazione unica è combinata con flessibilità e plasticità, la natura ha trovato un materiale eccezionale che ha permesso di creare una forma di movimento biologica superiore Della materia. La presenza di centri specifici è una proprietà comune delle proteine che svolgono funzioni biologiche specializzate. Questi sono gli "organi di lavoro" delle molecole proteiche. Grazie a appositi centri specifici, le proteine enzimatiche legano selettivamente le sostanze, i cui catalizzatori di trasformazioni chimiche sono le proteine antitossine, legano le tossine, ecc. Un sistema di interazioni è organizzato tra i gruppi chimici di un centro specifico e una molecola partner al contatto. Comprende, in primo luogo, l'attrazione elettrostatica tra gruppi con cariche elettriche opposte; secondo, i cosiddetti legami idrogeno tra gruppi elettricamente polari; e, infine, terzo, legami "idrofobici" - interazioni tra gruppi non polari (gruppi respinti dall'acqua). Di regola, i legami chimici stabili non sorgono qui, poiché ciascuna individualmente delle interazioni elencate è piuttosto debole. Ma in generale, il sistema di un centro specifico fornisce una forza sufficiente della connessione delle molecole. La suddetta selettività dell'azione di centri specifici è ottenuta grazie alla corrispondenza nella composizione e nella disposizione dei gruppi chimici nel centro stesso e nella molecola partner - la cosiddetta complementarità. Qualsiasi sostituzione o movimento di gruppi significa una violazione del complementare ™. È anche chiaro che un centro specifico non è solo un meccanismo funzionante, ma anche un cifrario che consente a una molecola proteica di “riconoscere” il suo partner tra molte altre molecole, anche quelle che hanno grande somiglianza con questo partner. Il concetto di centri specifici riflette solo il carattere generale dei meccanismi funzionali inerenti alle proteine. Le funzioni specifiche delle proteine, la struttura e le reazioni dei loro centri specifici rimangono un'area della scienza in cui resta quasi tutto da fare. Ciò vale anche per i processi di formazione di strutture biologiche supramolecolari. Alcune strutture biologiche sono estremamente complesse. Tali sono, ad esempio, membrane con * complessi enzimatici. L'assemblaggio di tali strutture viene effettuato, come mostrano i dati di altri studi, da un ampio sistema di numerosi componenti proteici.La partecipazione di molte proteine a questo lavoro è, apparentemente, solo indiretta: partecipano solo al processo di creazione di una struttura, ma non sono incluse nella sua composizione. Si presume che ci siano enzimi specifici tra queste proteine accessorie. D'altra parte, ci sono strutture biologiche che hanno una struttura relativamente semplice. Ad esempio, altre strutture fibrose sono costruite da molecole proteiche di un solo tipo. In parecchi casi in laboratori è possibile decomporre strutture biologiche semplici nei loro elementi individuali - proteine e altre molecole. In condizioni ambientali appropriate, questi elementi vengono nuovamente combinati da soli nel giusto ordine e ricreano la struttura originale. Questo processo di ricreazione è comunemente indicato come autoassemblaggio. Diversi gruppi di ricerca sia all'estero che nel nostro Paese ne stanno studiando i meccanismi. Uno di questi gruppi è il Laboratorio di strutture e funzioni proteiche dell'Istituto di biochimica, dove si studia l'autoassemblaggio delle fibre di fibrina. In condizioni favorevoli per il corpo nel sangue che circola attraverso vasi intatti, c'è un precursore solubile della fibrina - la proteina fibrinogeno. Quando i vasi sanguigni sono danneggiati, uno speciale sistema complesso di proteine inizia a produrre l'enzima trombina, che scinde quattro piccole particelle chiamate peptidi di fibrina da una grande molecola di fibrinogeno. Dopo averli persi, il fibrinogeno si trasforma in fibrina-proteina, la polimerizzazione (connessione tra loro) delle molecole di cui forma le fibre. Le molecole di fibrina monomerica polimerizzano con un ordine rigoroso, che è caratteristico di tutti i processi di autoassemblaggio. Gli studi sperimentali sui processi di autoassemblaggio richiedono soluzioni Pertanto, il primo problema che si pone davanti agli scienziati che intraprendono lo studio dei processi di autoassemblaggio è proprio lo "smantellamento" delle strutture biologiche. In ogni singolo caso, si devono cercare metodi di azione specifici per ciascuna struttura che rompano efficacemente i legami tra i suoi monomeri costituenti e non provochino alcun danno ai monomeri stessi. Per la fibrina, non è stato possibile per molto tempo trovare un modo completamente soddisfacente di decomposizione delle sue fibre polimeriche. Le soluzioni di urea inizialmente proposte per questo scopo e poi di bromuro di sodio erano inefficaci. Solo nel 1965, un dipendente del nostro laboratorio, TV Varetskaya, ha sviluppato un metodo che soddisfa completamente tutti i requisiti, basato sull'uso di soluzioni diluite di acido acetico a temperature prossime a 0 ° C.Le molecole di fibrina monomerica ottenute in questo modo sempre hanno le stesse proprietà, riprodotte di esperimento in esperienza. I metodi precedenti di decomposizione della fibrina in soluzioni di urea o bromuro di sodio non davano una tale costanza di proprietà: diversi campioni della proteina monomerica ottenuti con il loro aiuto differivano, ad esempio, in diverse velocità di polimerizzazione. È interessante notare che, quando un'altra proteina, la proteina strutturale dei mitocondri, viene ottenuta in uno stato disciolto, i migliori risultati (come hanno concluso gli scienziati americani che studiano l'autoassemblaggio di queste strutture) danno anche una soluzione diluita raffreddata di acido acetico. I processi coinvolti nell'autoassemblaggio delle strutture vengono studiati in vari modi.Uno di questi modi è uno studio sistematico dei risultati dell'influenza sul corso del processo di determinate sostanze. Ad esempio, un ritardo nella polimerizzazione della fibrina può essere causato dall'esposizione della soluzione monomerica di partenza a una soluzione acquosa di sali inorganici, in particolare cloruro di sodio. Entro i limiti di basse concentrazioni di sale - fino al 2-3% - il ritardo nella polimerizzazione è tanto più forte, quanto più "forte" è la soluzione. Quali informazioni fornisce questo fatto? È noto che i sali in una soluzione acquosa esistono sotto forma di ioni che trasportano cariche elettriche positive e negative. L'efficienza elettrostatica degli ioni di sale è solitamente stimata da un valore speciale: la forza ionica, che tiene conto della concentrazione della soluzione e dell'entità della carica dei suoi ioni. La natura chimica dei singoli ioni di sale è qui irrilevante. Il ritardo nella polimerizzazione è determinato principalmente dalla forza ionica della soluzione salina aggiunta alla soluzione proteica monomerica. Ciò dimostra che l'effetto è prevalentemente di natura elettrostatica. Ovviamente, gli ioni di sale schermano ("estinguono") le cariche elettriche delle molecole di fibrina monomerica - una circostanza che indica semplicemente che le loro cariche elettriche sono coinvolte nel meccanismo di connessione selettiva delle molecole proteiche. In condizioni normali - in assenza di interferenza da parte di ioni di sale caricati elettrostaticamente - gruppi ionici caricati positivamente e negativamente, che sono complementari situati in centri specifici, dovrebbero attrarre le molecole l'una verso l'altra. Studi più dettagliati effettuati nel nostro laboratorio da EV Lugovskii hanno dimostrato che, insieme all'effetto schermante generale della forza ionica, esiste un altro effetto dei sali, che dipende fortemente dalla natura chimica, dall'individualità degli ioni ed è determinato dalla loro capacità di attaccarsi a una proteina. L'attaccamento di uno ione a un centro specifico introduce apparentemente un ulteriore disturbo nel suo lavoro. E. V. Lugovskii ha studiato l'effetto di concentrazioni di sale più elevate sulla polimerizzazione. Si è scoperto che alcuni sali ritardano bruscamente, mentre altri, al contrario, accelerano la polimerizzazione. Quindi, ad esempio, due sali correlati, cloruro di sodio e bromuro, agiscono in modo opposto: il primo accelera e il secondo ritarda il processo. Come il bromuro, ma anche più forte, lo ioduro di sodio agisce, come il cloruro, con diversi punti di forza - a volte più forti, poi più deboli - agiscono solfati, fosfati e alcuni altri sali. Si è scoperto che per la forza dell'effetto accelerante sulla polimerizzazione della fibrina, i sali sono disposti in una fila che coincide con la fila consolidata e ben nota per "salare fuori" (precipitare) proteine in soluzioni con alte concentrazioni di sale. Tuttavia, negli esperimenti con la polimerizzazione della fibrina, non si verifica ancora la salatura reale, poiché il processo è studiato a concentrazioni saline che ancora non raggiungono quelle di salatura. Inoltre, durante la salatura, le proteine vengono precipitate sotto forma di una massa informe e, nel caso descritto, si sono formate normali fibre di fibrina, che potrebbero essere viste utilizzando un microscopio a contrasto di fase. Molti studi hanno riscontrato che la propensione di una proteina alla salatura è potenziata dalla presenza nelle sue molecole di gruppi non polari in prossimità della sua superficie ea contatto con l'ambiente. Più tali gruppi, minore è la concentrazione della soluzione salina, sufficiente per salare la proteina. Queste posizioni ben note possono essere usate per spiegare i risultati del nostro esperimento, in cui, senza dubbio, si manifesta un effetto di salatura, indicando che una molecola di fibrina monomerica dovrebbe contenere un gran numero di gruppi non polari sulla sua superficie. Ma non abbiamo un vero e proprio salting out. L'effetto di salatura si manifesta solo nell'accelerazione della specifica polimerizzazione. Ciò può essere spiegato solo dal fatto che i gruppi non polari sono componenti complementari di un centro specifico della molecola proteica. Pertanto, gli studi sull'effetto delle soluzioni saline sulla polimerizzazione della fibrina mostrano che sia le interazioni elettrostatiche che le interazioni "idrofobiche" tra gruppi non polari sono coinvolte nel processo di autoassemblaggio della fibrina. I dati di altri studi indicano che è coinvolto anche il terzo tipo di interazioni tra molecole proteiche: i legami idrogeno. Passiamo ora al fibrinogeno, il precursore della fibrina. Le sue molecole sono anche in grado di polimerizzare per formare fibre simili alla fibrina. Pertanto, anche i monomeri di fibrinogeno hanno centri specifici. Tuttavia, la loro polimerizzazione richiede condizioni speciali e, in particolare, un'elevata forza ionica della soluzione. Se la schermatura delle cariche elettriche ritarda la polimerizzazione della fibrina, al contrario, è un prerequisito per combinare i monomeri di fibrinogeno nella catena. Ma ne consegue che la localizzazione delle cariche elettriche in un centro specifico della molecola di fibrinogeno è sfavorevole alla polimerizzazione e dovrebbe essere effettuata solo attraverso l'interazione di quei gruppi chimici che non hanno una carica elettrica. I peptidi di fibrina, con la scissione di cui la molecola di fibrinogeno diventa una molecola di fibrina monomerica, trasportano cariche elettriche negative. Apparentemente, la loro rimozione è il fattore che cambia il sistema delle cariche in un centro specifico e crea complementarità. È interessante notare che uno dei tipi di sanguinamento, una grave malattia ereditaria, è causato da un cambiamento mutazionale nel fibrinogeno, in cui questa proteina perde le sue cariche positive vicino ai punti di scissione dei peptidi di fibrina. Questi ultimi, come nel caso normale, vengono scissi, ma la trombina non provoca più l'attivazione del fibrinogeno, (come mostra il diagramma, l'attivazione consiste nel fatto che una carica positiva vicina di un centro specifico viene rilasciata dall'effetto neutralizzante del peptide di fibrina Se non esiste tale carica, la scissione del peptide di fibrina diventa priva di significato: l'attivazione non si verifica.) Alcuni frammenti di fibrinogeno o fibrina sono caratterizzati da centri specifici difettosi, che, tuttavia, sono in grado di interagire selettivamente con la fibrina monomerica. Tali frammenti possono essere ottenuti dalla distruzione di queste proteine da parte degli enzimi. Negli esperimenti con loro, è facile osservare come i frammenti attivi interagiscono con la fibrina e interrompono l'assemblaggio delle fibre. Sono proprio questi esperimenti - la produzione e lo studio di frammenti attivi - che il nostro laboratorio è attualmente impegnato. Si spera che studiando la struttura e le reazioni selettive di questi frammenti capiremo meglio come le proteine stesse vengono costruite e agiscono. La complementarità dei gruppi ionici, che gioca un ruolo così essenziale nell'autoassemblaggio della fibrina, è, apparentemente, importante anche nell'autoassemblaggio di altre strutture biologiche. La quota dell'energia dei legami elettrostatici nella quantità totale dell'energia di interazione delle molecole di connessione è probabilmente piccola. Più essenziali per la connessione delle molecole sono i legami "idrofobici". Ma i gruppi ionici possono accelerare l'autoassemblaggio. Le cariche elettrostatiche possono interagire su una distanza relativamente lunga. Ed è la loro azione a lungo raggio che permette, probabilmente, di "sondare" l'ambiente, di riconoscere il partner desiderato e di contattarlo in modo orientato. Ciò suggerisce che durante l'assemblaggio di strutture molto complesse, che avviene in più fasi, devono agire anche enzimi specifici come la trombina.È facile immaginare la seguente sequenza di reazioni: una proteina precursore destinata, ad esempio, a partecipare a due reazioni di assemblaggio, viene attivata dal primo enzima e si combina con uno specifico partner; questo lo rende disponibile per il secondo enzima e il successivo attaccamento specifico del secondo partner. È possibile che questo sia proprio il meccanismo di organizzazione di quelle strutture biologiche, la cui complessità esclude la possibilità di un autoassemblaggio diretto. Nelle fasi intermedie dell'assemblaggio di strutture complesse, gli enzimi possono essere non solo strumenti di attivazione. La loro azione può alterare le proprietà generali delle proteine. Ad esempio, una certa proteina, già “incorporata” in una struttura, può diventarne una parte insolubile, avendo perso una parte significativa dei suoi componenti idrofili a causa degli enzimi. Ovviamente, un tale schema non ne esclude altri, implicando la possibilità dell'esistenza di proteine di trasporto che trasportano proteine insolubili al sito di assemblaggio. In conclusione, va notato che lo studio dei processi di assemblaggio di strutture biologiche supramolecolari è un'area piena di domande poco chiare e complesse. Pertanto, in questa fase del suo sviluppo, le informazioni sui processi che si verificano in sistemi relativamente semplici come il sistema di formazione delle fibre di fibrina sono particolarmente interessanti e utili. V. Belitser Pubblicazioni simili
|
| Bidimensionalità fisiologica dell'informazione: meccanismi e conseguenze | Prova con L-Dopa |
|---|
Nuove ricette
 La biologia moderna è penetrata profondamente nelle profondità della cellula - il "mattone" dei vivi. Una cellula vivente è apparsa agli scienziati come una combinazione armoniosa di strutture più semplici: membrane, tubi, granuli, formazioni fibrose, costituite da molecole ordinate collegate tra loro.
La biologia moderna è penetrata profondamente nelle profondità della cellula - il "mattone" dei vivi. Una cellula vivente è apparsa agli scienziati come una combinazione armoniosa di strutture più semplici: membrane, tubi, granuli, formazioni fibrose, costituite da molecole ordinate collegate tra loro.